
在地球上,各类生物不停地进行着生命活动,为生存和繁衍而努力。从只能在显微镜下才能看到的细菌到世界上现存最大的生物蓝鲸,它们都是由细胞构成。细胞是生物体基本的结构和功能单位,已知除病毒之外的所有生物均由细胞构成,并且病毒的生命活动也必须在细胞中才能体现。
生物体依赖各类细胞活动来进行一系列复杂的生命活动。例如,动物运动依赖于肌细胞的收缩,生物生长或增殖依赖于细胞的分裂,生物感知环境则依赖于神经元细胞内部信息的传递。细胞活动是生物体内的重要过程,而生物体内大部分细胞活动都依赖于一种具有马达功能的蛋白质大分子,这种大分子蛋白质叫做分子马达。
分子马达由生物大分子构成,能够将化学能转化为机械能。分子马达作为具有特定结构的蛋白质,能够通过自身的运动来推动细胞活动。不同类型的分子马达在细胞内具有不同的功能和分布,共同协助细胞完成各种生物活动。
沿轨道运动的线性分子马达
许多分子马达沿着细胞骨架进行线性运动,是细胞移动、分裂等细胞活动的主力军。细胞骨架由蛋白质构成的长圆柱丝组成,可伸长至几十微米,延伸到细胞各个角落。在细胞这个大工厂内,分子马达单纯依靠自身扩散难以到达目的地。然而,细胞骨架在细胞内构建了有序组织的轨道,结合到细胞骨架上的分子马达利用化学能进行机械做功,攀附轨道运动到达目的地完成任务。线性分子马达本质上是ATP酶,通过消耗细胞内的能量货币ATP(三磷酸腺苷)获得动力,其主要包括肌球蛋白、动力蛋白、驱动蛋白。
肌球蛋白最早由德国生理学家Kühne发表在“原生质研究”单行本中,其详细介绍了他在研究肌肉收缩时发现当加以研磨的青蛙肌肉浸渍在10%食盐水中,会抽提出一种粘稠的物质。在该物质中加入部分水可使之凝结并获得沉淀。Kühne认为此凝结物是肌肉中起收缩作用的关键物质,并将其命名为肌球蛋白,但是受限于生物技术,无法实现肌球蛋白提纯和生物功能分析。一直到1939年人们才发现肌球蛋白具有ATP酶活性。而后人们便开始在体外观察肌球蛋白的运动。1942年,匈牙利科学家发现肌球蛋白主要结合在细胞骨架中的肌动蛋白丝上。肌动蛋白丝也称微丝,是直径约为7nm的螺旋状纤维,存在于所有真核细胞中。真核生物中肌球蛋白有35类家族,人体内有12类。它们的结构略有差别,功能各异。部分肌球蛋白参与细胞膜组织,比如肌球蛋白I,拥有单个头部结构域,通过脂质相互作用直接与膜结合,参与胞吞活动;部分肌球蛋白组合在一块工作,比如肌球蛋白Ⅱ,像桥一样连接肌动蛋白丝,对肌动蛋白丝施加拉力或推力,实现整体的收缩运动;部分肌球蛋白负责物质运输,比如肌球蛋白Ⅴ,是典型的双头分子马达,一端的两个头部结合在肌动蛋白丝上,另一端结合细胞器上的特异性受体,承载着分子“货物”,起到运输的作用。
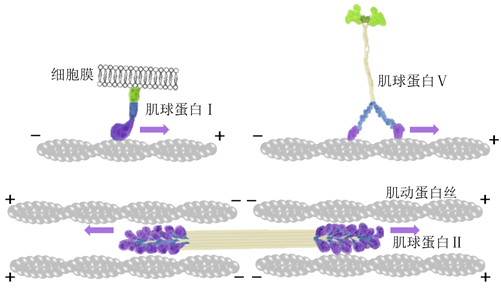
动力蛋白于1963年在对纤毛和鞭毛运动的研究中被发现并命名。动力蛋白结合在细胞骨架中的微管上,向微管负端定向运动。微管由两种微管蛋白亚基堆叠而成,是外径为25nm、内径15nm的中空管状的长蛋白丝。动力蛋白主要可分为两类:细胞质动力蛋白和轴丝动力蛋白。细胞质动力蛋白负责货物的运输。其一端结合微管,另一端结合动力蛋白激活蛋白加载货物。轴丝动力蛋白交联两根二联体微管(并排连在一起的两根微管),使微管形成局部弯曲,从而驱动纤毛或鞭毛整体的摆动。
驱动蛋白于1985年在研究乌贼神经元内囊泡的运输时被发现并命名。驱动蛋白与动力蛋白一样结合在微管上运动。除了少部分驱动蛋白和动力蛋白一样朝着微管负端定向运动,大部分驱动蛋白都朝着微管正端运动。还有一些驱动蛋白利用扩散作用到达微管的末端调节微管长度,无法主动运动。驱动蛋白可以分为14个亚家族(驱动蛋白-1至驱动蛋白-14),这些蛋白在细胞中的囊泡和细胞器的运输过程以及有丝分裂过程中发挥着重要作用。驱动蛋白作为体积最小的分子马达,运动结构域仅为肌球蛋白的三分之一和动力蛋白的十分之一。更小的运动结构域有利于科学家对驱动蛋白运动的结构和功能进行分析研究,因此对驱动蛋白实验探究和运动分析的研究课题极为丰富。
线性分子马达通常结合在细胞骨架上运动,并参与细胞移动、分裂等细胞活动。它们的蛋白质结构中都包括细胞骨架结合域和核苷酸(ATP、ADP)结合域,是细胞内精妙的分子机器。了解分子马达如何将化学能转化为自身的机械能是实现分子马达行为预测以及分子马达生物功能分析的关键步骤。
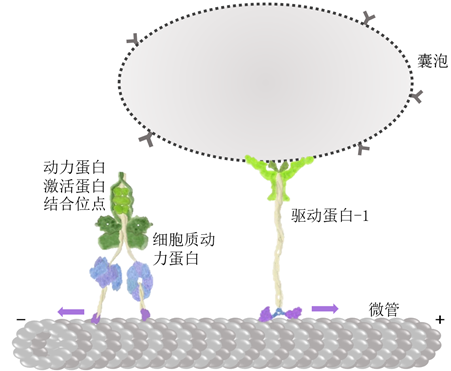
图2 细胞质动力蛋白和驱动蛋白-1的工作示意图。细胞质动力蛋白的紫色区域为微管结合域,蓝紫色球形区域为动力蛋白的两个头部,负责结合转化ATP。细胞质动力蛋白的绿色区域为尾部,可以和动力蛋白激活蛋白结合,从而加载货物。驱动蛋白-1的紫色区域为头部,蓝色区域为颈链,黄色区域为棒状螺旋。微管两端分别为正端与负端,微管从正端生长(聚合),负端缩短(解聚)。
ATP循环驱动前进
当我们看到汽车的时候,会想知道汽车为什么加了油就能跑。那么面对线性分子马达,我们也疑惑为什么线性分子马达在有ATP时,就能沿着微管走呢。
由于驱动蛋白通过微管运输细胞器的运动机制较其他分子马达的运动机制更为简单,且单个驱动蛋白分子能够沿着微管长距离移动而不脱落,更容易被观察和统计单分子的运动特性。所以我们以驱动蛋白-1为例,来了解它是如何利用细胞中的能量货币ATP来实现步进运动。驱动蛋白-1是一种双头分子马达,负责朝着微管正端运输货物。它的头部是其主要运动结构域。结合在微管上的驱动蛋白-1的头部能够前进、后退,也可以从微管上脱离掉落。在微管周围而未结合在微管上的驱动蛋白-1头部能够捕捉到空缺的微管结合位点并与之结合。
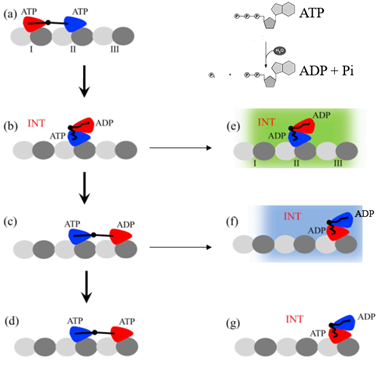
驱动蛋白的两个头部都能够结合并水解ATP,在ATP脱去一个磷酸基团Pi变成ADP时获得动力。头部与微管之间结合力的大小与头部结合的核苷酸状态有关,处于ADP态的头部,即头部与ADP结合时,与微管的结合力较弱,处于ATP态、ADP+Pi态以及空核苷酸态的头部与微管的结合作用较强。以驱动蛋白-1消耗一个ATP分子的过程为一个循环,驱动蛋白-1的运动就是不断的消耗ATP。一个循环的工作过程如下所述。
首先,两个头部均结合在微管上,且各结合一个ATP分子。当后面头部结合的ATP水解并释放出Pi时,剩下ADP态的头部与结合的微管位点之间的结合能变弱,该头部从微管上脱离并悬浮在空中。由于两个头部之间存在吸引,后面的头部会停留在前面的头部附近。当结合在微管上的前头处于ADP+Pi态时,与之连接的颈链可与另一颈链对接。此后,两个头部之间的相互吸引变弱,悬浮头会脱离吸附头开始扩散,并有较大几率结合到吸附头结合位点更前的位点,也有一定几率回到初始微管结合位点。重新结合到微管上的头部会释放ADP,空出核苷酸结合位点准备下一次结合ATP。若在悬浮头结合到微管前,前头也释放一个Pi,则驱动蛋白的两个头部都处于ADP状态,与微管的结合力较弱,极有可能从微管上脱离。此时,驱动蛋白-1消耗了一个ATP分子,在这个过程中可能向前迈进,也可能向后退步,也可能从微管脱离。
驱动蛋白-1的头部承担着运动的功能,驱动蛋白-1中间较长的棒状螺旋也会影响驱动蛋白-1在微管上的行走与脱落。将驱动蛋白-1中间较长的棒状螺旋想象成一个弹簧,当驱动蛋白-1的头部朝着微管正端前进一步时,弹簧变形并产生弹力,从而拉动货物前进。若货物被固定住,弹簧可能会施加持续的弹力,影响驱动蛋白-1的步进效率和从微管上脱离的速率。
了解单个驱动蛋白如何消耗ATP完成自身的机械运动,我们可以改造驱动蛋白以达到预想效果。例如,改变驱动蛋白不同结构域上的氨基酸或改变驱动蛋白颈链的长度等都能使驱动蛋白动力学特性改变,这些被改变的驱动蛋白可以被应用于纳米级别的细胞任务。基于单个驱动蛋白的运动模型,我们可以预测多个驱动蛋白合作时的功能效果;可以通过其他驱动蛋白有限的已知条件去计算得到它的其他运动参数;可以通过计算制定异常细胞中分子马达的调控策略,以达到治疗疾病的目的。
目前仅确定了少数分子马达的工作原理,本文介绍了驱动蛋白-1的行进机制,基于此的计算结果和多项课题研究数据吻合。单个分子马达的力量和能力是有限的。线性分子马达常常聚集在细胞骨架上,提供更大的力量以完成更灵活多样的任务。大部分细胞活动需要多种马达的集体合作,比如细胞的有丝分裂和神经元细胞的信息传递。
参考文献
[1][1] Hirokawa, N. Kinesin and Dynein Superfamily Proteins and the Mechanism of Organelle Transport. Science 1998, 279(5350), 519-526.
[2] Xie, P. Theoretical Analysis of Dynamics of Kinesin Molecular Motors. ACS Omega 2020, 5(11), 5721-5730.
[3] Xie, P. Insight into the chemomechanical coupling mechanism of kinesin molecular motors. Commun. Theor. Phys. 2021, 73(5), 57601.
 最前沿的电子设计资讯
最前沿的电子设计资讯